AIが科学者の共同研究者となる未来:Gemini 2.0 基盤の「AI co-scientist」とは
科学の発展は、常に人間の知的好奇心と創造性によって推進されてきました。しかし、現代の科学、特に生物医学の分野では、扱うべき知識の範囲が広大になり、専門性が深く求められる一方で、分野を横断した広い知識から新たな発見が生まれることも少なくありません。このような状況を打破し、科学研究を加速させるための新たな試みとして、Googleの研究者たちが開発したのが「AI co-scientist」です。
本記事では、この革新的なAIシステムがどのような仕組みで、どのように科学研究を支援するのかを、論文の内容に基づいて詳しく解説していきます。
引用元
- 論文名: Towards an AI co-scientist
- URL: https://storage.googleapis.com/coscientist_paper/ai_coscientist.pdf
- 発行日: 2025年2月18日
・あくまで個人の理解に基づくものであり、正確性に問題がある場合がございます。必ず参照元論文記事をご確認ください。
・本記事内での画像は、上記論文より引用しております。
本論文の要点
- Google DeepMindによって開発されたGemini 2.0を基盤とするマルチエージェントシステム「AI co-scientist」が紹介されています。
- AI co-scientistは、科学者が設定した研究目標に基づき、新たな知識の発見や独創的な研究仮説の提案を支援することを目的としています。
- このシステムは、科学的手法に着想を得た「生成、議論、進化」というアプローチを採用し、大規模な計算リソースを活用することで仮説生成を加速させます。
- AI co-scientistは、薬剤再利用、新規ターゲット発見、細菌進化と薬剤耐性のメカニズム解明という3つの生物医学分野で開発と検証が進められています。
- 実際の実験室での検証により、AI co-scientistが提案した急性骨髄性白血病(AML)の薬剤再利用候補、肝線維症の新規エピジェネティックターゲット、そして細菌の遺伝子伝達メカニズムに関する仮説が有望な結果を示しています。
本論文の詳細解説
1. 導入
現代の科学、特に生物医学分野の研究者は、知識の深さと広さという二つの課題に直面しています。一つのテーマを深く掘り下げる専門知識が必要とされる一方で、分野を超えた知識の組み合わせから画期的な発見が生まれることもあります。しかし、科学論文の急速な増加や高度な実験技術の普及により、専門分野の知識と分野横断的な視点の両方を習得することが難しくなっています。
実際、近年では分野融合的な研究から多くのブレークスルーが生まれています。例えば、CRISPR-Cas9というゲノム編集技術は、微生物学、遺伝学、分子生物学といった多様な分野の技術と戦略を組み合わせることで実現し、2020年のノーベル化学賞を受賞しました。また、AIシステムの開発においても、物理学と神経科学のアイデアが融合し、2024年のノーベル物理学賞につながる成果が生まれています。
このような背景を踏まえ、研究者が創造的に分野を横断し、専門的な知識に基づいて推論することを支援するシステムが求められています。AI技術の急速な進歩は、そのような知的で協調的なシステムの実現を可能にしつつあります。

2. 関連研究
AIを活用した科学的発見は、近年注目を集めている分野です。特に、大規模な深層学習モデルや生成モデルの開発により、AIが科学研究において重要な役割を果たすことが明確になってきました。AlphaFold 2によるタンパク質構造予測の飛躍的な進歩は、その代表的な例であり、構造生物学や創薬の分野に大きな変革をもたらしています。他にも、AIによる新しい抗生物質の開発やタンパク質設計、材料発見などの成功例が報告されています。
さらに、近年の研究では、AI、特にLLM(大規模言語モデル)ベースのシステムを、仮説生成から論文作成までの研究ワークフロー全体に統合するという、より野心的な目標が探求されています。
例えば、LLMが研究論文のフィードバックを提供する有用性を評価した研究では、GPT-4が生成したフィードバックが、人間のレビュー担当者によるフィードバックと高い一致度を示し、研究者の多くがその有用性を認めています。しかし、この研究は科学プロセスのフィードバック段階に限定されており、仮説形成から実験検証、論文作成までの全サイクルにおけるLLMの統合については未解明な点が多く残されています。
また、科学文献の検索と要約を行うAIエージェントであるPaperQA2は、複数の文献調査タスクにおいて、PhDやポスドクの研究者を超える性能を示したと報告されています。しかし、このシステムは情報の合成には優れていますが、新規の仮説生成のための科学的推論は行いません。
HypoGeniCというシステムは、LLMと多腕バンディット法に触発されたアプローチを用いて、仮説生成に取り組んでいます。しかし、その評価は過去のデータに依存しており、真に新規な仮説を生成できるかは疑問が残ります。
Virtual Labは、LLMエージェントのチームが科学的な問題を解決するシステムであり、実験的な検証も行われています。一方、「The AI Scientist」というシステムは、複数のLLMエージェントが研究の全段階を自動的に行うことを目指していますが、自動評価が限定的であるという課題があります。
生物医学分野におけるAIの活用も進んでおり、汎用LLMや専門LLMが、生物医学的な推論や質問応答において高い性能を示しています。Med-PaLM 2は、マウスの遺伝的要因の特定に成功するなど、LLMによる仮説生成と発見の初期の例を示しています。
薬剤再利用の分野では、知識グラフを用いた手法などが有望ですが、知識グラフの範囲に限界があります。専門的な生物医学基盤モデルであるTxGNNは、新規疾患に対する薬剤再利用に取り組んでいますが、基となる知識グラフの質に依存し、十分な拡張性と説明性がありません。
AI co-scientistは、これらの関連研究を踏まえ、科学的推論と仮説生成のためのマルチエージェントフレームワークを、追加の学習技術なしに設計しています。
3. AI co-scientistの紹介
AI co-scientistは、Gemini 2.0を基盤とし、非同期タスク実行フレームワーク内に統合されたマルチエージェントアーキテクチャを採用しています。これにより、テスト時の計算リソースを柔軟に拡張し、高度な科学的推論を可能にします。
専門の科学者が自然言語で研究目標を指定すると、AI co-scientistは、以下のデフォルト基準に従って仮説と研究提案を生成します:
- 提供された研究目標との整合性:生成された出力は、科学者によって定義された研究目標、好み、制約に正確に合致する必要があります。
- 妥当性:システム出力には、明白な欠陥があってはなりません。先行研究や確立された知識との矛盾がある場合は、明示的に述べられ、正当化される必要があります。
- 新規性:AI co-scientistシステムの重要な目的は、既存の情報を単に合成するのではなく(これは既存の「ディープリサーチ」ツールで対応済みです)、先行研究に基づいた新規な仮説、推測、研究計画を生成することです。
- 検証可能性:システム出力は、科学者によって指定された制約内で実験的に検証可能である必要があります。
- 安全性:システム出力は、安全でない、非倫理的な、または有害な研究を可能にしないように制御されます。
これらのデフォルト基準に加えて、必要に応じて追加の基準、好み、制約を設定することもできます。例えば、解釈可能性や可読性を向上させるために、研究者が好む形式で出力を生成するように構成できます。
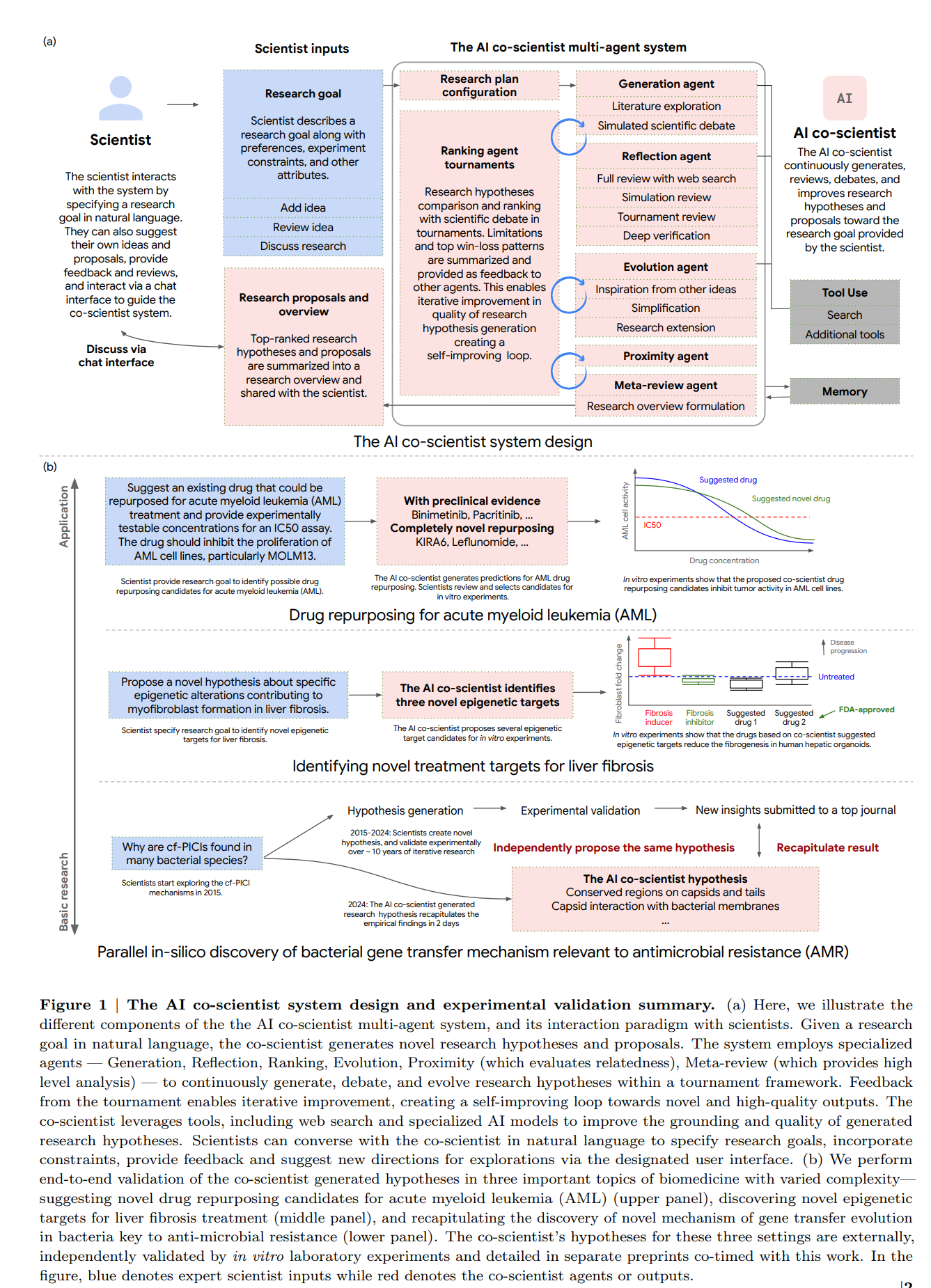
AI co-scientistのシステムは、主に以下の4つの主要なコンポーネントで構成されています:
- 自然言語インターフェース:科学者は、主に自然言語を通じてシステムと対話し、監督します。これにより、最初の研究目標を定義するだけでなく、いつでもそれを修正したり、生成された仮説(自身の解決策を含む)に関するフィードバックを提供したり、システムの進行を全体的に導いたりすることができます。
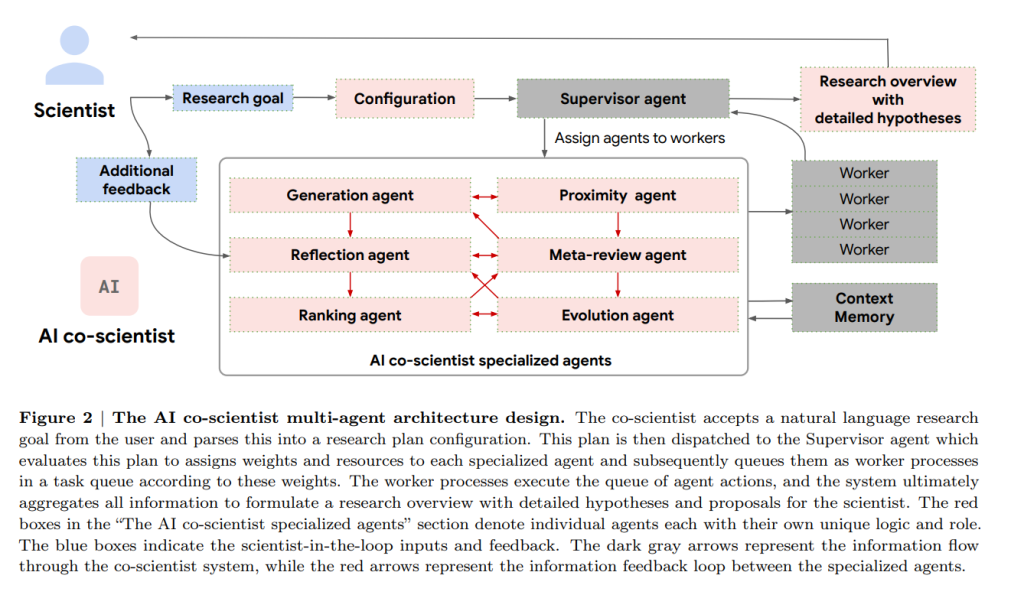
- 非同期タスクフレームワーク:AI co-scientistは、特殊化されたエージェントが非同期、継続的、および構成可能なタスク実行フレームワーク内でワーカープロセスとして動作するマルチエージェントシステムを採用しています。Supervisorエージェントは、ワーカータスクキューを管理し、これらのプロセスに特殊化されたエージェントを割り当て、リソースを配分します。この設計により、システムは計算リソースを柔軟かつ効果的に利用し、科学的推論能力を反復的に向上させることができます。
- 特殊化されたエージェント:科学的手法から導き出された帰納的バイアスと科学的予備知識に従い、科学的推論と仮説生成のプロセスはサブタスクに分解されます。個々の特殊化されたエージェントは、カスタマイズされた指示プロンプトを備えており、これらのサブタスクを実行するように設計されています。これらのエージェントは、Supervisorエージェントによって調整されたワーカーとして動作します。
- コンテキストメモリ:長期にわたる反復計算と科学的推論を可能にするために、AI co-scientistは、計算中にエージェントとシステムの状態を保存および取得するための永続的なコンテキストメモリを使用します。
Gemini 2.0モデルは、AI co-scientistシステムのすべてのエージェントを支える基盤となるLLMです。
研究目標が科学者によって指定されると、AI co-scientistシステムはそれを解析し、研究提案を生成するための研究計画構成を導き出します。この構成は、望ましい提案の好み、属性、制約を捉えます。例えば、AI co-scientistが新規の仮説のみを提案すべきかどうかを指定したり、新規性や実験的実現可能性などの仮説の質を評価するための基準を指定したりします。
Supervisorエージェントは、研究計画構成に基づいてタスクキューの作成を開始し、特殊化されたエージェントのオーケストレーションを開始します。システムは継続的かつ非同期的に動作します。Supervisorエージェントは定期的に、システムの全体的な計算のターミナル状態に達したかどうかを判断し、リソース割り当てに関する決定を通知する包括的な統計セットを計算します。状態は定期的にシステムの関連コンテキストメモリに書き込まれ、その後の計算ラウンドでフィードバックとして利用されます。
AI co-scientistの中核となるのは、Supervisorエージェントによってオーケストレーションされる特殊化されたエージェントの連合です。これらのエージェントは、科学的推論プロセスをエミュレートするように設計されており、新規の仮説と研究計画を生成することができます。また、APIを通じて、Web検索エンジンや特殊化されたAIモデルなどの外部ツールと対話する機能も備えています。
以下に、特殊化されたエージェントを示します:
- Generationエージェント:研究プロセスを開始し、最初の焦点領域を生成し、それらを反復的に拡張し、研究目標に対処する初期の仮説と提案のセットを生成します。これには、Web検索を使用した関連文献の探索、既存の調査結果の新規な方向への合成、および反復的な改善のためのシミュレートされた科学的議論への参加が含まれます。
- Reflectionエージェント:科学的ピアレビュー担当者の役割をシミュレートし、生成された仮説と研究提案の正確性、質、および新規性を批判的に検討します。さらに、特に十分に説明されていない可能性のある既存の研究観察(文献検索とレビューを通じて特定)に対する改善された説明を提供する各仮説の可能性を評価します。
- Rankingエージェント:AI co-scientistシステムの重要な抽象化は、反復的な改善を可能にするために異なる研究提案が評価およびランク付けされるトーナメントの概念です。Rankingエージェントは、いつでも生成された仮説を評価および優先順位付けするために、Eloベースのトーナメントを採用およびオーケストレーションします。これには、各提案の相対的なメリットのニュアンスのある評価を可能にする、シミュレートされた科学的議論によって促進されるペアワイズ比較が含まれます。
- Proximityエージェント:このエージェントは、生成された仮説の近接グラフを非同期的に計算し、類似のアイデアのクラスタリング、重複排除、および仮説ランドスケープの効率的な探索を可能にします。
- Evolutionエージェント:AI co-scientistの反復的な改善機能は、トーナメントから上位ランク付けされた仮説を継続的に洗練するこのエージェントに大きく依存しています。その洗練戦略には、既存のアイデアの合成、類推の使用、支持の詳細のための文献の活用、非従来的な推論の探索、および明確にするための概念の簡素化が含まれます。Evolutionエージェントは新しい仮説を生成します。既存の仮説を変更または置き換えることはありません。
- Meta-reviewエージェント:このエージェントは、すべてのレビューから洞察を合成し、トーナメントディベートで繰り返されるパターンを特定し、これらの調査結果を使用して、後続の反復で他のエージェントのパフォーマンスを最適化することにより、AI co-scientistの継続的な改善も可能にします。エージェントは、上位ランク付けされた仮説とレビューを包括的な研究概要に合成し、科学者によるレビューのために提供します。Meta-reviewエージェントは、フィードバック伝播と学習をバックプロパゲーション技術(微調整や強化学習など)なしに実現します。
科学者は、エキスパートインザループのデザインを通じて、AI co-scientistを積極的に導くことができます。科学者は、生成された仮説と研究概要を考慮して最初の研究目標を洗練したり、生成された仮説の手動レビューを提供したり、自身の仮説や提案をトーナメントに含めてシステム生成の仮説や提案と並べてランク付けしたり、特定の研究方向を追跡するようにAI co-scientistに指示したりすることができます。
AI co-scientistは、仮説と研究提案の生成、レビュー、改善の際に、Web検索やドメイン固有のツール、科学者のプライベートリポジトリ、さらにはAlphaFoldのような特殊なAIモデルからのフィードバックなど、さまざまなツールを活用します。
4. 評価と結果
AI co-scientistシステムの評価は、その基盤となる戦略と指標のベンチマークと検証を目的としています。その後、ドメイン専門家との小規模な評価を実施し、システムの品質を評価しました。さらに、システムの新規予測の実用性を評価するために、薬剤再利用、新規治療ターゲットの発見、抗菌剤耐性の根底にあるメカニズムの解明という3つの重要な生物医学アプリケーションにおいて、AI co-scientistが生成した仮説と研究提案のエンドツーエンドのウェットラボ検証(実験室実験)も実施しました。
- EloレーティングとAI co-scientistの高品質な結果との一致:Elo自動評価レーティングは、AI co-scientistシステム内の自己改善フィードバックループを導く重要な指標です。GPQAベンチマークデータセットを用いた分析により、より高いEloレーティングが、より高い品質の結果と相関していることが示されました。
- テスト時の計算量スケーリングによるAI co-scientistの科学的推論の改善:トーナメントの過程におけるAI co-scientistが生成した仮説と提案のEloレーティングを測定することで、テスト時の計算量スケーリングの効果と、反復的な科学的推論と仮説生成におけるAI co-scientistの進歩を評価しました。その結果、計算リソースの増加に伴い、Eloレーティングが向上し、仮説の品質が改善される傾向が確認されました。
- 専門家によるAI co-scientistの結果の潜在的な新規性と影響力の評価:キュレーションされた11の研究目標に対して、専門家がAI co-scientistや他のLLMベースラインモデルの出力を評価しました。その結果、AI co-scientistの出力が最も好まれ、新規性と影響力の両方で高い評価を得ました。
- 敵対的な研究目標を用いたAI co-scientistの安全性評価:1200の敵対的な例を用いて、AI co-scientistが危険な研究目標を拒否できるかどうかを評価しました。この予備的な分析では、システムはすべてのチェックに成功しました。
AI co-scientistによる薬剤再利用
- 専門家が評価した妥当性の高い薬剤再利用候補の提案:2300の承認済み薬剤と33の癌種からなるキュレーションされたリストを用いて、AI co-scientistに薬剤再利用仮説を探索させました。専門の腫瘍医が上位ランクの薬剤-癌ペアをレビューし、有望な候補をin vitroウェットラボ検証のために選択しました。
- NIH Specific Aims Page形式での薬剤再利用提案の臨床専門家による評価:AI co-scientistが生成した薬剤再利用仮説をNIHスタイルの助成金申請Specific Aims Page形式に再構成し、6名の専門血液腫瘍医に評価を依頼しました。その結果、提案は全体的に高い品質であると評価されました。
- 急性骨髄性白血病に対する新規薬剤再利用候補の特定:臨床専門家からの肯定的なフィードバックに基づき、AI co-scientistが提案した急性骨髄性白血病(AML)の薬剤再利用仮説について、in vitroウェットラボ検証実験を実施しました。既存のpreclinical evidenceのある5つの薬剤候補と、新規の3つの薬剤候補をテストした結果、Binimetinib、Pacritinib、Cerivastatin、そして新規候補のKIRA6がAML細胞株の増殖を抑制することが示されました。特にKIRA6は、既存のアプローチや専門家の情報源では選択されなかった可能性のある新規候補であり、有望な結果を示しました。
AI co-scientistによる肝線維症の新規治療ターゲットの発見
AI co-scientistに、肝線維症におけるエピジェネティックな変化の役割に関する実験的に検証可能な仮説を生成させ、既存の薬剤でターゲットにできるエピジェネティック修飾因子を特定させました。その結果、提案された3つの新規エピジェネティックターゲットのうち2つを標的とする薬剤が、ヒト肝臓オルガノイドにおいて有意な抗線維化活性を示しました。そのうち1つは他の適応症でFDA承認済みの薬剤であり、肝線維症治療への再利用の可能性を示唆しています。
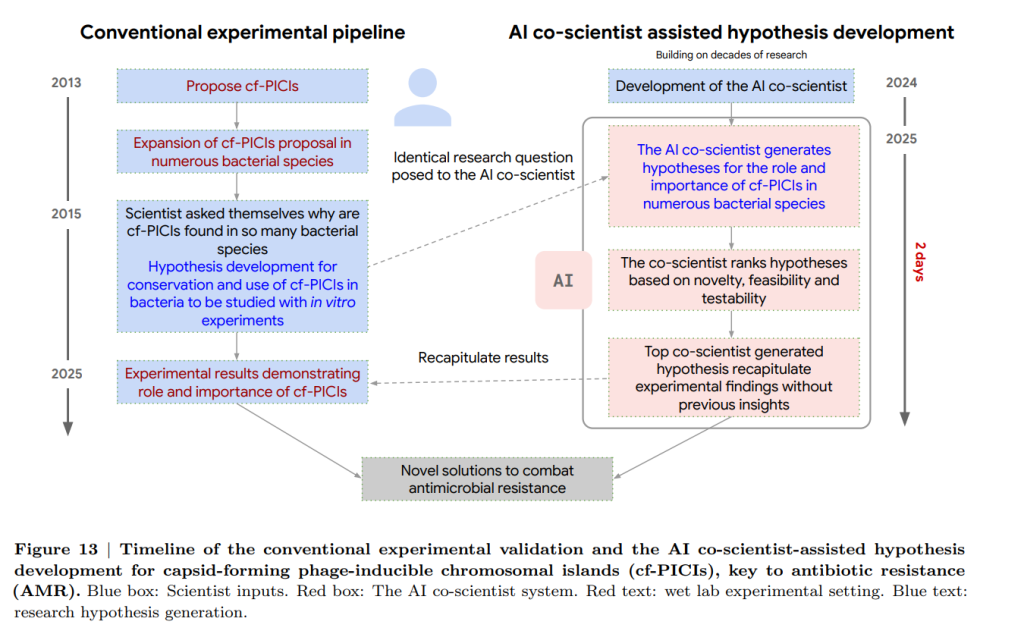
AI co-scientistによる抗菌剤耐性における画期的な発見の再現
抗菌剤耐性において重要な役割を果たすカプシド形成ファージ誘導性染色体島(cf-PICIs)に焦点を当て、AI co-scientistにその広範な宿主域の進化的根拠を説明する研究提案を生成させました。その結果、AI co-scientistは、cf-PICIs要素が多様なファージの尾部と相互作用して宿主域を拡大するという、当時未発表であった実験研究の画期的な発見を独立して正確に提案しました。この発見は、専門の研究者による実験的検証と一致するものであり、AI co-scientistが科学研究を増強し、補完し、加速する可能性を示しています。
5. 限界
AI co-scientistの評価は初期段階であり有望な結果を示していますが、いくつかの限界も存在します。
- 文献検索、レビュー、推論の限界:システムはオープンアクセス文献に依存しているため、重要な先行研究を見逃す可能性があります。また、関連性がないと誤って判断した場合にも先行研究を考慮しないことがあります。
- ネガティブな結果データへのアクセス不足:公開された文献のみを使用するため、実験の失敗などのネガティブな結果データへのアクセスが限られています。このようなデータは公開されにくい傾向がありますが、経験豊富な科学者は研究の優先順位付けに利用しています。
- マルチモーダル推論とツール利用能力の改善の必要性:科学論文にはテキストだけでなく、図表などのビジュアルデータも重要な情報を含んでいます。現在の最先端モデルでも、そのようなデータを十分に活用できていない可能性があり、AI co-scientistも例外ではありません。また、ドメイン固有の生物医学マルチモーダルデータセットや知識グラフからの情報を推論し統合する能力も評価されていません。
- より良い指標と広範な評価の必要性:現在の評価には、AIによる自動評価、専門家レビュー、標的を絞ったin vitro検証が含まれていますが、システム性能の評価は予備的なものです。多様な生物医学および科学分野にわたる包括的かつ系統的な評価が必要です。また、高品質な論文の厳密さと詳細さを満たす出力を生成するための継続的な改善が必要です。さらに、自己改善に用いられているEloレーティングは限定的な自動評価指標であり、専門家の視点や好みをより良く反映する、より客観的な評価指標の継続的な調査が重要です。
- 基盤となるLLMの継承された限界:LLMの限界として、不完全な事実性やハルシネーション(もっともらしい嘘)があり、これらはAI co-scientistシステムにも伝播する可能性があります。
6. 安全性と倫理的影響
AI co-scientistのようなAIシステムは、科学的発見を加速する可能性を提供する一方で、科学的方法そのものへの影響とは異なる、重大な安全性と倫理的課題も提起します。安全性のリスクは、デュアルユース(両用性)、つまり科学的ブレークスルーが有害な目的のために悪用される可能性に集中しています。倫理的リスクは、特定の科学分野における確立された倫理規範と慣習に矛盾する研究に関わります。
論文では、これらの異なるリスクカテゴリーを検討し、それらを完全に理解し軽減するためにはさらなる研究が不可欠であることを強調しています。
AI co-scientistには、現在以下の安全メカニズムが組み込まれています:
- 公開された最先端LLMへの依存:安全性評価とセーフガードが組み込まれている確立された公開Gemini 2.0モデルを利用しています。
- 初期研究目標の安全性レビュー:入力された研究目標は自動的に安全性評価を受け、危険と判断された目標は拒否されます。
- 研究仮説の安全性レビュー:研究目標が安全と判断された場合でも、生成された仮説は安全性についてレビューされ、危険な仮説はトーナメントから除外され、それ以上開発されず、ユーザーに提示されません。
- 研究方向の継続的モニタリング:Meta-reviewエージェントが研究方向の概要を提供し、潜在的な安全性の懸念を継続的に監視し、危険な研究方向が検出された場合はユーザーに警告します。
- 説明可能性と透明性:安全性レビューを含むすべてのシステムコンポーネントは、最終的な推奨事項だけでなく、システム決定を正当化および監査するために使用できる詳細な推論トレースを提供します。
- 包括的なロギング:すべてのシステム活動はログに記録され、将来の分析と監査のために保存されます。安全性評価とレッドチーミング:危険な研究目標の検出の堅牢性と正確性を確保するために、予備的なレッドチーミングが実施されました。
- 信頼できるテスタープログラム:システムの有用性と堅牢性に関する実際のフィードバックを収集するために、科学者向けの信頼できるテスタープログラムを通じてシステムへのアクセスを可能にする予定です。
最も重要なことは、AI co-scientistは継続的な人間の専門家による監督の下で動作するように設計されており、最終的な決定は常に専門家の判断を行使する科学者によって行われることが保証されています。
7. 今後の研究
AI co-scientistは初期開発段階にあり、改善の余地が多くあります。
- 早期の改善:文献レビューの強化、外部ツールとのクロスチェック、事実性チェックの改善、引用の想起率の向上などが挙げられます。
- 拡張された評価:より客観的な評価指標の開発、自動化された文献ベースの検証やシミュレートされた実験の組み込みなどが重要な分野です。
- 能力の向上:強化学習による仮説ランキング、提案生成、進化的洗練の強化、テキストだけでなく画像、データセット、主要な公開データベースの統合、より複雑な実験計画の処理などが考えられます。
8. 考察
本研究は、エージェント型AIシステムによる新規科学的発見の加速への初期的な試みであり、その広範な影響について考察しています。AI co-scientistは、「生成、議論、進化」というアプローチを通じて仮説を反復的に洗練させます。この設計は、自動評価指標によって測定されるように、研究仮説生成のための自己改善サイクルを生み出し、科学的推論のためのテスト時計算量スケーリングの潜在的な利点を示しています。
より重要なことに、本研究は、複数の実験室における実験結果を通じて、AI co-scientistの仮説の検証を示しています。薬剤再利用において、AI co-scientistは、現在の前臨床知識を超えた新しい再利用の機会の特定を含め、臨床的に関連する濃度でin vitro有効性を示したAMLの新規候補を特定します。肝線維症については、AI co-scientistは新しいエピジェネティック治療ターゲットを提案し、その後のin vitro実験により、FDA承認済み薬剤を含むいくつかの提案された化合物の抗線維化活性が検証されました。抗菌剤耐性の分野では、AI co-scientistは、細菌種間のcf-PICI伝達メカニズムに関する新しい未発表の発見を独立して再現しました。さまざまな科学的複雑さを持ついくつかのクエリに対する初期の結果は、AI co-scientistがさまざまな生物医学分野での発見に貢献する可能性を示唆しています。
ここで報告されている実験では、AI co-scientistは特別な事前学習、事後学習、または強化学習フレームワークを必要としませんでした。既存の基盤LLMの能力を活用しており、AI co-scientistシステム自体の再トレーニングを必要とせずに、それらのモデルの更新から潜在的に恩恵を受けるため、計算効率と汎用性の利点があります。システムアーキテクチャには、自己対話、内部一貫性チェック、およびトーナメントベースのランキングが組み込まれており、反復的な仮説生成、評価、および洗練をサポートします。これは、時間の経過に伴う仮説の品質の観察された改善に反映されています。この自己進化は、データベースクエリを含む拡張されたツール使用統合によってさらに改善され、AI co-scientistが既存の知識に基づいて提案を裏付け、新しいつながりを特定できるようになります。将来的には、AI co-scientist自体が生成したデータとトーナメントランキングをフィードバックとして活用し、強化学習を使用してシステム全体を改善する可能性があります。
これらのAI co-scientistシステム内で使用されている最先端LLMは、推論、論理、および科学文献の理解の一部を含む、急速に改善された能力の継続的な傾向を示しています。システムはモデルに依存しないように設計されているため、最先端LLMのさらなる改善はAI co-scientistのパフォーマンスの向上にもつながり、ツールの最適なエージェント的使用を含む新しい研究の道が開かれるでしょう。
これらの進歩は、さまざまな生物医学および科学分野に大きな影響を与えます。例えば、AI co-scientistの薬剤候補選択プロセスへの統合は、エビデンスに基づいた薬剤再利用における大きな進歩を示しています。単なる文献マイニングを超えて、AI co-scientistは、分子経路、既存の前臨床エビデンス、および潜在的な治療応用を構造化された検証可能な特定目的(specific-aims)に結び付けることにより、新しいメカニズムの洞察を合成できる可能性があります。この能力は、研究者に文献で裏付けられた根拠を提供し、検証のための具体的な実験アプローチを示唆するため、特に価値があります。
注目すべきことに、AI co-scientistの構造化された出力は、同情的使用例のための包括的な単一患者IND(Investigational New Drug)申請の開発に活用できます。メカニズムのエビデンス、関連する前臨床データ、および提案されたモニタリングパラメータを系統的に提示することにより、AI co-scientistは、標準的な治療オプションを使い果たし、臨床試験の対象とならない難治性疾患の患者に対して、十分に考慮された治療プロトコルの開発を促進するのに役立ちます。このアプリケーションは、従来の薬剤開発のタイムラインが緊急の患者ニーズと一致しない可能性のあるまれなまたは攻撃的な疾患において特に価値があります。
薬剤再利用におけるAI co-scientistの応用は、元の希少疾患の適応症からの広範な安全性および臨床データがすでに存在するオーファンドラッグにとって非常に魅力的な機会を提供します。フェーズIII臨床試験には数億ドルの費用がかかる可能性があるため、これらの十分に特性評価された治療薬を再利用することは、複数の疾患にわたって治療オプションを拡大するための効率的な道を提供します。これは、オーファンドラッグが他の状態にも関連する可能性のある基本的な生物学的経路を標的とすることが多く、これらのつながりは従来の調査アプローチではすぐには明らかにならない可能性があるため、特に重要です。既存の臨床データ、安全性の結果、およびメカニズムの洞察を系統的に評価することにより、AI co-scientistは、薬剤開発と安全性検証にすでに投資されたものを活用しながら、有望な新しい治療応用を特定するのに役立ちます。
AIの利用に関する懸念と今後の展望
ただし、AIを生物医学と科学の可能性を最大限に実現するには、潜在的な落とし穴に積極的に対処する必要があります。協調的なAIシステムにおけるAIが生成した提案への過度の依存は、批判的思考を低下させ、研究の均質性を高める可能性があります。AIの創造性とアイデア形成への影響に関する研究では、意見が分かれており、アイデアの均質化のリスクを示唆するものもあれば、それほど決定的ではないものもあります。同様のトレーニングデータによるLLMの相関する成功/失敗モードは、科学的探求を人為的に狭める可能性もあります。さらに、AIシステムの盲点と研究分野間の性能のばらつきを考慮する必要があります。したがって、スケーラブルな事実性検証方法、ピアレビュー、および潜在的なバイアスの慎重な検討が不可欠です。
これらのリスクにもかかわらず、AIは科学情報へのアクセスを民主化し、特に歴史的に無視され、リソースが限られた分野に利益をもたらすことで、発見を加速する大きな可能性を秘めています。本質的に、AIは科学の進歩の「潮位を高め」、歴史的に取り残されてきた人々を含むすべての船を持ち上げることができます。この可能性を実現するには、戦略的な投資と、偽陽性を最小限に抑えながらアイデア形成とイノベーションを促進するためのAIシステムの慎重な調整が必要です。これには、歴史的に無視されてきた研究トピックに焦点を当てることや、既存のデータの量が異なるさまざまな科学分野におけるパフォーマンスのばらつきに対処することが含まれます。
現在のAIシステムは段階的なアイデアや研究仮説を生み出す傾向があるかもしれませんが、現在進行中の開発は、真に独創的で非正統的で変革的な科学理論を生み出すことができるシステムを作成することを目的としています。これらの課題への積極的な軽減策により、AIはすべての科学者にとって強力なツールとなり、科学的探求のより公平で革新的な未来を促進することが保証されます。
9. 結論
AI co-scientistは、科学者のAI支援による増強と科学的発見の加速に向けた有望な一歩を示しています。多様な科学および生物医学分野にわたって検証可能な新しい仮説を生成する能力(一部は実験結果によって裏付けられています)と、計算量の増加に伴う再帰的な自己改善の能力は、人間の健康、医学、および科学における壮大な課題を解決するための科学者の努力を有意義に加速する可能性を示しています。
このイノベーションは、数多くの疑問と機会を開きます。AI co-scientistシステム自体に科学の経験的かつ責任あるアプローチを適用することで、協調的で人間中心のAIシステムが人間の創意工夫を増強し、科学的発見を加速する方法を含む、その疑いのない可能性の安全な探求が可能になります。